نویسنده:
Sara Rhodes
تاریخ ایجاد:
12 فوریه 2021
تاریخ به روزرسانی:
26 ژوئن 2024

محتوا
- مراحل
- روش 1 از 3: pH چیست؟
- روش 2 از 3: pH را با غلظت شناخته شده محاسبه کنید
- روش 3 از 3: محاسبه غلظت از pH شناخته شده
- نکات
در زندگی روزمره ، pH معمولاً به عنوان مقیاسی برای توصیف بی طرفی یا برعکس ، عدم خنثی بودن یک ماده درک می شود. از نظر علمی ، مقدار pH مربوط به مقدار یون در یک محلول شیمیایی است. اگر در حال مطالعه شیمی یا موضوعات مرتبط هستید ، ممکن است لازم باشد سطح pH را بر اساس غلظت مواد در محلول محاسبه کنید. مقدار pH با استفاده از فرمول زیر یافت می شود: pH = -lg [H3O].
مراحل
روش 1 از 3: pH چیست؟
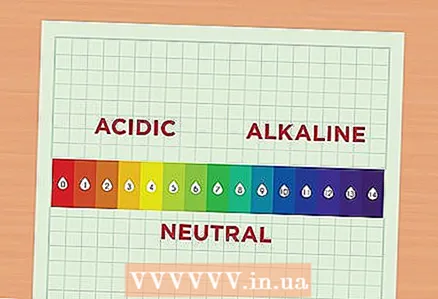 1 با pH آشنا شوید. مقدار pH مربوط به غلظت یونهای هیدروژن در محلول است. محلول با افزایش غلظت یونهای هیدروژن اسیدی و محلول با غلظت کاهش یافته این یونها قلیایی نامیده می شود. یونهای هیدروژن به طور خلاصه به عنوان H. تعیین می شوند. آنها همچنین می توانند به عنوان بخشی از یک ترکیب نشان داده شوند ، سپس آنها هیدرونیوم نامیده می شوند و به صورت H نوشته می شوند.30.
1 با pH آشنا شوید. مقدار pH مربوط به غلظت یونهای هیدروژن در محلول است. محلول با افزایش غلظت یونهای هیدروژن اسیدی و محلول با غلظت کاهش یافته این یونها قلیایی نامیده می شود. یونهای هیدروژن به طور خلاصه به عنوان H. تعیین می شوند. آنها همچنین می توانند به عنوان بخشی از یک ترکیب نشان داده شوند ، سپس آنها هیدرونیوم نامیده می شوند و به صورت H نوشته می شوند.30. - مقیاس pH را بخوانید. مقیاس pH از 1 تا 14 متغیر است. هرچه عدد کمتر باشد ، محلول اسیدی تر است. برعکس ، هرچه مقدار بیشتر باشد ، محلول قلیایی تر است. به عنوان مثال ، pH آب پرتقال 2 است زیرا این آب یک مایع نسبتاً اسیدی است. سفید کننده کلر دارای pH 12 است زیرا حاوی مقدار زیادی قلیا است. در وسط مقیاس محلول های نسبتاً خنثی مانند آب وجود دارد که pH آن 7 است.
- تفاوت 1 نقطه ای بین دو محلول در مقیاس pH به این معنی است که اسیدیته آنها با ضریب 10 متفاوت است. به عنوان مثال ، اگر دو محلول با pH 6 و 7 مصرف کنید ، اسیدیته محلول اول با pH 6 10 برابر اسیدیته محلول دوم با pH 7 خواهد بود. و به عنوان مثال ، اسیدیته محلول با pH 6 100 برابر اسیدیته محلول با pH 8 است.
 2 معادله تعیین pH را به خاطر بسپارید. مقیاس pH با استفاده از لگاریتم اعشاری منفی محاسبه می شود. لگاریتم اعشاری منفی مربوط به تعداد صفرهای قبل از یک ، شامل صفر صحیح است: به عنوان مثال ، لگاریتم اعشاری منفی 0.1 برابر 1 ، 0.01 برابر 2 و غیره است. فرمول برای یافتن pH به شرح زیر است: pH = -lg [H3O].
2 معادله تعیین pH را به خاطر بسپارید. مقیاس pH با استفاده از لگاریتم اعشاری منفی محاسبه می شود. لگاریتم اعشاری منفی مربوط به تعداد صفرهای قبل از یک ، شامل صفر صحیح است: به عنوان مثال ، لگاریتم اعشاری منفی 0.1 برابر 1 ، 0.01 برابر 2 و غیره است. فرمول برای یافتن pH به شرح زیر است: pH = -lg [H3O]. - گاهی فرمول به صورت pH = -lg [H] نوشته می شود. فرقی نمی کند که معادله H باشد3O یا H ، هر دو معادل هستند.
- برای یافتن pH لازم نیست بتوان لگاریتم اعشاری را محاسبه کرد ، زیرا تقریباً هر ماشین حساب علمی یا مهندسی گزینه ای برای محاسبه آن دارد.
 3 با تمرکز آشنا شوید. غلظت یک ماده با تعداد ذرات این ماده موجود در محلول مطابقت دارد. به عنوان یک قاعده ، غلظت در تعداد مول در واحد حجم بیان می شود و به صورت m / V یا M نشان داده می شود. در آزمایشگاه های شیمیایی ، غلظت محلول ها روی آنها روی بطری ها نوشته می شود. اگر در حال حل یک مشکل شیمیایی هستید ، غلظت را می توان در شرایط ذکر کرد ، یا باید آن را پیدا کرد.
3 با تمرکز آشنا شوید. غلظت یک ماده با تعداد ذرات این ماده موجود در محلول مطابقت دارد. به عنوان یک قاعده ، غلظت در تعداد مول در واحد حجم بیان می شود و به صورت m / V یا M نشان داده می شود. در آزمایشگاه های شیمیایی ، غلظت محلول ها روی آنها روی بطری ها نوشته می شود. اگر در حال حل یک مشکل شیمیایی هستید ، غلظت را می توان در شرایط ذکر کرد ، یا باید آن را پیدا کرد.
روش 2 از 3: pH را با غلظت شناخته شده محاسبه کنید
 1 فرمول یافتن pH را به خاطر بسپارید. در اینجا فرمول است: pH = -lg [H3O]. اطمینان حاصل کنید که با تمام عناصر تشکیل دهنده این فرمول آشنا هستید. ببینید چه مقدار با غلظت مطابقت دارد.
1 فرمول یافتن pH را به خاطر بسپارید. در اینجا فرمول است: pH = -lg [H3O]. اطمینان حاصل کنید که با تمام عناصر تشکیل دهنده این فرمول آشنا هستید. ببینید چه مقدار با غلظت مطابقت دارد. - در شیمی ، پرانتز مربع به معنی غلظت چیزی است.بنابراین فرمول محاسبه pH عبارت است از "pH برابر لگاریتم منفی غلظت یون هیدرونیوم است."
 2 غلظت واقعی را تعیین کنید. بیانیه مشکل را با دقت بخوانید. غلظت اسید یا قلیایی را در داده های منبع پیدا کنید. فرمول کامل را روی یک تکه کاغذ بنویسید و مقادیر شناخته شده را جایگزین کنید. برای جلوگیری از سردرگمی ، همیشه واحدهای اندازه گیری را در کنار اعداد نشان دهید.
2 غلظت واقعی را تعیین کنید. بیانیه مشکل را با دقت بخوانید. غلظت اسید یا قلیایی را در داده های منبع پیدا کنید. فرمول کامل را روی یک تکه کاغذ بنویسید و مقادیر شناخته شده را جایگزین کنید. برای جلوگیری از سردرگمی ، همیشه واحدهای اندازه گیری را در کنار اعداد نشان دهید. - به عنوان مثال ، اگر غلظت آن 1.05 10 10 M باشد ، فرمول محاسبه pH را به صورت زیر بنویسید: pH = -lg [1.05 10 10 M]
 3 pH را محاسبه کنید. استفاده از ماشین حساب علمی برای این کار راحت است. ابتدا با فشار دادن دکمه "+/-" علامت منفی را وارد کنید. سپس دکمه "log" مربوط به لگاریتم اعشاری را فشار دهید (در انگلیسی ، لگاریتم اعشاری به عنوان log نامیده می شود). صفحه نمایش "-log" را نشان می دهد. سپس براکت چپ را فشار داده و غلظت را وارد کنید. در صورت لزوم مقدار درجه را فراموش نکنید. سپس براکت ها را ببندید. در نتیجه ، "-log (1.05x10) را در صفحه ماشین حساب خواهید دید. روی "=" کلیک کنید. مقدار PH شما باید تقریباً 4.98 باشد.
3 pH را محاسبه کنید. استفاده از ماشین حساب علمی برای این کار راحت است. ابتدا با فشار دادن دکمه "+/-" علامت منفی را وارد کنید. سپس دکمه "log" مربوط به لگاریتم اعشاری را فشار دهید (در انگلیسی ، لگاریتم اعشاری به عنوان log نامیده می شود). صفحه نمایش "-log" را نشان می دهد. سپس براکت چپ را فشار داده و غلظت را وارد کنید. در صورت لزوم مقدار درجه را فراموش نکنید. سپس براکت ها را ببندید. در نتیجه ، "-log (1.05x10) را در صفحه ماشین حساب خواهید دید. روی "=" کلیک کنید. مقدار PH شما باید تقریباً 4.98 باشد.
روش 3 از 3: محاسبه غلظت از pH شناخته شده
 1 تعیین کنید چه چیزی داده شده است و چه چیزی را می خواهید پیدا کنید. فرمول محاسبه pH را بنویسید. سپس مقادیر شناخته شده را با نوشتن مقادیر آنها تحت فرمول مشخص کنید. به عنوان مثال ، اگر می دانید که pH شما 10.1 است ، این عدد را در فرمول خود زیر pH بنویسید.
1 تعیین کنید چه چیزی داده شده است و چه چیزی را می خواهید پیدا کنید. فرمول محاسبه pH را بنویسید. سپس مقادیر شناخته شده را با نوشتن مقادیر آنها تحت فرمول مشخص کنید. به عنوان مثال ، اگر می دانید که pH شما 10.1 است ، این عدد را در فرمول خود زیر pH بنویسید.  2 تبدیل فرمول در این صورت ، شما نیاز به دانش دوره جبر مدرسه دارید. برای محاسبه غلظت از مقدار pH شناخته شده ، لازم است فرمول را طوری تغییر دهیم که غلظت از هر دو طرف معادله جدا باشد. یعنی لازم است که در یک طرف علامت مساوی یک عبارت حاوی مقدار pH وجود داشته باشد و در طرف دیگر - غلظت هیدرونیوم. ابتدا هر دو طرف معادله را در -1 ضرب کنید. سپس 10 قدرت را در دو طرف برابری حاصله افزایش دهید.
2 تبدیل فرمول در این صورت ، شما نیاز به دانش دوره جبر مدرسه دارید. برای محاسبه غلظت از مقدار pH شناخته شده ، لازم است فرمول را طوری تغییر دهیم که غلظت از هر دو طرف معادله جدا باشد. یعنی لازم است که در یک طرف علامت مساوی یک عبارت حاوی مقدار pH وجود داشته باشد و در طرف دیگر - غلظت هیدرونیوم. ابتدا هر دو طرف معادله را در -1 ضرب کنید. سپس 10 قدرت را در دو طرف برابری حاصله افزایش دهید. - تبدیل برابری pH = -log [H3O] ، فرمول + [H را بدست می آوریم3O] = 10 ، یعنی غلظت یون برابر توان -pH است. اکنون ، به جای pH ، یک مقدار شناخته شده را جایگزین می کنیم ، در مورد ما 10.1.
 3 معادله را حل کنید. یک روش خاص برای افزایش ده در توان ماشین حساب وجود دارد. ابتدا 10 را تایپ کنید و سپس کلید توان را فشار دهید. علامت منهای و مقدار درجه را وارد کنید. روی "=" کلیک کنید.
3 معادله را حل کنید. یک روش خاص برای افزایش ده در توان ماشین حساب وجود دارد. ابتدا 10 را تایپ کنید و سپس کلید توان را فشار دهید. علامت منهای و مقدار درجه را وارد کنید. روی "=" کلیک کنید. - در مثال ما ، pH 10.1 است. "10" را شماره گیری کرده و کلید "EXP" را فشار دهید. سپس "- / +" را فشار دهید و علامت را تغییر دهید. در نهایت ، مقدار pH "10.1" را وارد کرده و کلید "=" را فشار دهید. در نتیجه ، باید با 1e-100 به پایان برسید. این بدان معناست که غلظت 1.00 10 10 M است.
 4 پاسخی را که دریافت کرده اید در نظر بگیرید. آیا از نظر جسمانی منطقی است؟ اگر pH 10.1 باشد ، بدین معنی است که غلظت هیدرونیوم بسیار کم است و شما محلول قلیایی دارید. بنابراین ، غلظت بسیار کم یافت شده مربوط به
4 پاسخی را که دریافت کرده اید در نظر بگیرید. آیا از نظر جسمانی منطقی است؟ اگر pH 10.1 باشد ، بدین معنی است که غلظت هیدرونیوم بسیار کم است و شما محلول قلیایی دارید. بنابراین ، غلظت بسیار کم یافت شده مربوط به
نکات
- اگر محاسبه سطح pH در ابتدا دشوار است ، به خاطر داشته باشید که منابع زیادی برای کسب اطلاعات بیشتر در مورد این موضوع وجود دارد. از یک کتاب شیمی استفاده کنید یا از معلم بخواهید به شما کمک کند.